[fb_button]
Autorem poniższego tekstu jest Dr Tim Wijgerde. Artykuł jest publikowany na Reefhub.pl na zasadach Creative Commons. [button color=”normal” size=”small” link=”http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0092781″ target=”_blank” ]Link do oryginału[/button]
Wstęp
Światło odgrywa istotną role we wzroście, rozrodzie i fizjologii korali kalcyfikujących, które zawierają zooksantelle. [1, 2, 3, 4]. Dotąd, większość badań nad wpływem światła na zooxantelle skupiała sie na ilości promieniowania w zakresie światła widzialnego. Tylko niewiele badań poświęcone było indywidualnej roli poszczególnych kolorów w zakresie światła widzialnego [5, 6, 7, 8]. Powszechnie wiadomo, że różne barwy świała są wykorzystywane w różnym stopniu przez korale żyjące w symbiozie z zooxantellami, miedzy innymi ze względu na rożna absorpcję rożnych długości fal światła widzialnego przez wode morską. [8] Absorpcja jest najsilniejsza w zakresie fal o dłuższych długościach np barwa czerwona, i dlatego krótsze fale np niebieskie penetrują kolumnę wody głębiej. Niebieskie światło ma wyraźny wpływ na wzrost korali, wybarwienie, foto-fizjologie definiującą wzrost korala i zooxantelli, zawartość chlorofilu a (większa ilość zooxantelli, lub wieksza ilość chlorofilu na zooxantelle) produkcje barwników fotosyntetyzujących oraz na tempo procesu fotosyntezy. [5, 6, 7, 8]. Ostatnio Wang LH [11] badał wpływ spektrum światła na wzrost i fotosyntezę zooxantelli usuniętych z korala (Symbiodinium sp., clade B) i wykazał, że niebieskie światło jest podstawą do zachowania procesów komórkowych i wzrostu tych zooxantelli. Czerwone i podczerwone światło na prawie całkowite zahamowanie podziałów mitotycznych komorek Symbidinium sp. Pomimo że badania Wanga [11] i Kinziego [5] wykazały, że wzrost korala i zooxantelli jest uwarunkowane obecnością niebieskiego światła, nie ma jasności co do tego, jak czerwone światło jest neutralne dla korali, zooxantelli i ich fizjologii.
Niniejsza praca powstała właśnie po to, żeby odpowiedzieć na pytanie, czy czerwone światło działa na korale neutralnie czy też, szkodliwie. Badanie polega na przetestowaniu indywidualnego i łączonego wpływu, wąskiego zakresu światła czerwonego i niebieskiego na zdrowie, gęstość zooxantelli oraz foto-fizjologię korala Stylophora pistillata. Dodatkowo określimy jak te barwy wpływają na ogólne wybarwienie tego gatunku, ponieważ D’Angelo [7] odkrył, że produkcja kolorowych barwników fluorescencyjnych, rzekomo działających jako foto filtry i antyoksydanty [12, 13, 14] jest stymulowana przez barwę niebieską. Wystawiliśmy fragmenty S.pistillata na wąskie spektrum czerwonego i niebieskiego światła i ich połączenia na dwóch poziomach promieniowania (128 i 256 umol m-2 s-1). Ta moc światła odpowiada ilości niebieskiego i czerwonego światła w pierwszych 10 metrach głębokości przy przy mocy na powierzchni wody 2000 umol m-2 s-1. Jako próbkę kontrolną zastosowaliśmy kontrolne źródło światła o pełnym spektrum widzialnym, również po to aby móc porównać wyniki z wcześniejszymi badaniami [4, 17]. Wnioski z tego badania pomogą nam zrozumieć zależności pomiędzy światłem niebieskim i czerwonym, a foto fizjologią korali. Dodatkowo, nasze wyniki mogą wspomóc rozwój akwakultur korali, które zależą od atrakcyjnego ubarwienia i niższych kosztów ich prowadzenia [4, 17, 18].
Materiały i Metody
Oświadczenie:
Korale zostały udostępnione przez Burgers Zoo BV (Arnhem, Holandia). Eksperyment został przeprowadzony na Uniwersytecie Wageningen (Wageningem Holandia) za pozwoleniem Burgers ZOO BV. Eksperyment nie wymagał pozwolenie Komitetu Etyki, ponieważ korale są wyłączone z ustawy o testach przeprowadzanych na żywych zwierzętach w Unii Europejskiej (Dyrektywa 2010/63/EU)
Przygotowanie korali do eksperymentu
Do badania użyliśmy 70-ciu sztuk szczepek korala SPS Stylophora pistillata (Esper 1797). Fragmenty korala zostały losowo pocięte z losowo wybranych kolonii o identycznym pochodzeniu genetycznym i pionowo przyklejone na płytki PVC 5×5 cm za pomocą kleju cyjanoakrylowego. Szczepki przygotowaliśmy z rosnących główek o wielkości ok 1cm następnie pozostawiliśmy je na 7 tygodni w 400L zbiorniku aby doszły do siebie przed sześciotygodniowym eksperymentem. Akwarium, w którym czekały szczepki oświetlone było światłem z lampy 4x54w T5 o pełnym spektrum i o energii 190 umol m-1 s-1 w dwunastogodzinnym reżimie noc-dzień (Foto 1). Za cyrkulacje odpowiadała pompa Tunze 6085 dająca przepływ rzędu 8000l/h. Kolonie macierzyste szczepek trzymane byly w podobnych warunkach przez ostatnich 5 lat. Do system eksperymentalnego o całkowitej pojemności 3000L, użyto cztery pompy Tunze 6085 dające łączną cyrkulację o przepływie rzedu 32000L/h, odpieniacz Deltec MCE600 i 20Watowa lamba UV zasilana pompą Eheim 1000. Stałe zasolenie utrzymywane było dzięki układowi dolewki automatycznej. Korale były odżywiane 25ml zawiesiną naupliusów Artemii (około 3000 sztuk) dwa razy w tygodniu.
Parametry utrzymywane były na następujących poziomach:
zasolenie 35.2±0.2 g/L,
temperatura 26.0±0.4°C,
pH 8.2±0.3,
amoniak-N 0.01±0.01 mg/L,
azotany-N 0.30±0.05 mg/L,
fosforany-P 0.28±0.03 mg/L,
wapń 378±39 mg/L,
alkaliczność 3.49±0.34 mEq/L (N = 2-18).
Poziom mikroelementów zmierzony byl raz za pomocą plazmowego spektrometru masowego (ICP-MS):
mangan 1.41 μg/L,
cynk 79.70 μg/L,
kadm <0.6 μg/L,
kobalt <0.5 μg/L,
chrom <0.5 μg/L,
miedź <3.0 μg/L,
żelazo <6.0 μg/L,
nikiel <1.2 μg/L,
ołów <4.0 μg/L.
Światło
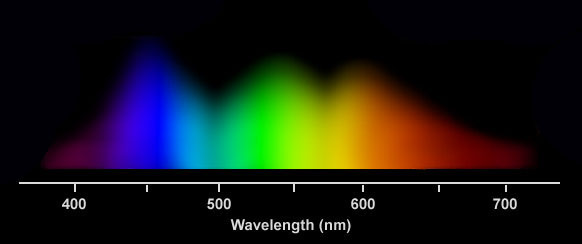
Po siedmiu tygodniach, szczepki zostały losowo przydzielone do siedmiu różnych źródeł światła (10 sztuk na lampę): niebieskie, czerwone, 50/50 niebieskie i czerwone, o mocy 128 i 256umol m-2 s-1, oraz do źródła światła białego o mocy 128umol m-1 s-1 (Foto 1). Podczas całego eksperymentu stosowano dwunastogodzinny reżim oświetlenia. Lampy: niebieska, czerwona i 50/50 zbudowane były z sześciu diod LED o o łącznej mocy 120-168Watt. Do uzyskania dwóch poziomów oświetlenia wyłączono trzy z sześciu diód za pomocą wbudowanego oprogramowania. Źródło pełnego spektrum światła to lampa4x80W T5 dająca identyczne światło jak w zbiorniku przejściowym. Korale na podstawkach PCV umieszczone zostały na głębokości 43cm -grupa testowa i na 74 cm grupa kontrolna. W celu upewnienia sie, że każdy koral dostaje tyle samo światła i taką samą cyrkulację, wszystkie szczepki były rotacyjnie przestawiane w obrębie swojego światła dwa razy w tygodniu przez okres całego eksperymentu. Poziom światła (w zakresie PAR) był zmierzony przy koralach w zbiorniku eksperymentalnym co 10 cm za pomocą miernika LI-COR 192SA a następnie dokładnie ustawiony na wartości 128 i 256 umol m-2 s-1 dla odpowiednich próbek. Pomiar długości fali światła niebieskiego i czerwonego emitowanego przez diody LED, odbył sie za pomocą skalibrowanego spektrometru HR4000 firmy Ocean Optics. Niebieskia lampa 168W emitowała światło o piku przy 452nm i o szerokości 73nm. Lampa czerwona 120w, odpowiednio pik przy 665nm o szerokości 74nm. Lampa 50/50 czerwono-niebieska 144w pokazała pokazała oczywiście kombinacje tych dwóch wykresów. (Foto 1) Lampa T5 emitowała promieniowanie świetlne przez zakrec całego światła widzilnego. Trzeba nadmienić, że według wykresu, lampa ta dawała około 3 razy więcej światła niebieskiego niż czerwonego.
Gęstość Zooksantelli
Gęstość zooksantelli w szczepkach S. pistillata, była zbadana po sześciu tygodniach eksperymentu. Cztery losowo wybrane szczepki z każdej grupy zostało odcięte od podstawek PCV, zważone, a następnie przeniesione do specjalnych 50ml pojemników. Tkanka korala została usunięta za pomocą strumienia sprężonego powietrza. Następnie do pojemników nalano 10ml ASW (sztuczna woda morska) i każdy pojemnik był intensywnie wytrząsany, aby usunąć resztki tkanki ze szkieletu, oraz ze ścianek pojemników. Po usunięciu szkieletu za pomocą pęsety rurki zostały odwirowane przez 10 minut w temperaturze 4C w wirówce ustawionej na 4000 obrotów na minutę. Otrzymany osad zawierał warstwę tkanki i warstwę cięższych zooxantelli. Został ostrożnie wyjęty z pojemników, zalany 750ml AWS i przełożony do komory liczącej firmy Neubaurer w celu komputerowego przeliczenie.
Współczynnik odbicia
Co tydzień dokonywaliśmy pomiaru odbitego widma w zakresie 190-892nm. Pomiaru dokonywaliśmy spectrometrem USB2000 ze światłowodem o średnicy 400um. Żeby zminimalizować odbicia tła, każda szczepka była przenoszona do czarnego kontenera wypełonionego wodą z eksperymentalnego systemu. Światłowód umieszczany był prostopadle do powierzchni korala w doległości około 3mm.Podczas pomiaru, zarówno koral jak i biała płytka referencyjna oświetlane były białym światłem halogenowym wycelowanym w próbki pod kątem około 45 stopni.Przed pomiarem wykonano również kalibrację mającą na celu usunięcia szumów spectrometru. Każdy koral był badany z czterech stron a odczyty były uśredniane. Przez cały czas trwaania eksperymentu odczyty odbitego vidma były robione z tych samych miejsc na szczepkach.
Analiza fotograficzna
Na koniec eksperymentu, fotografowaliśmy trzy losowo wybrane korale z każdej grupy. Każda ze szczepek umieszczona była w 60L akwarium z wodą z głównego systemu. Wszystkie szczepki fotografowane były na tych samych ustawieniach aparatu.
Wyniki
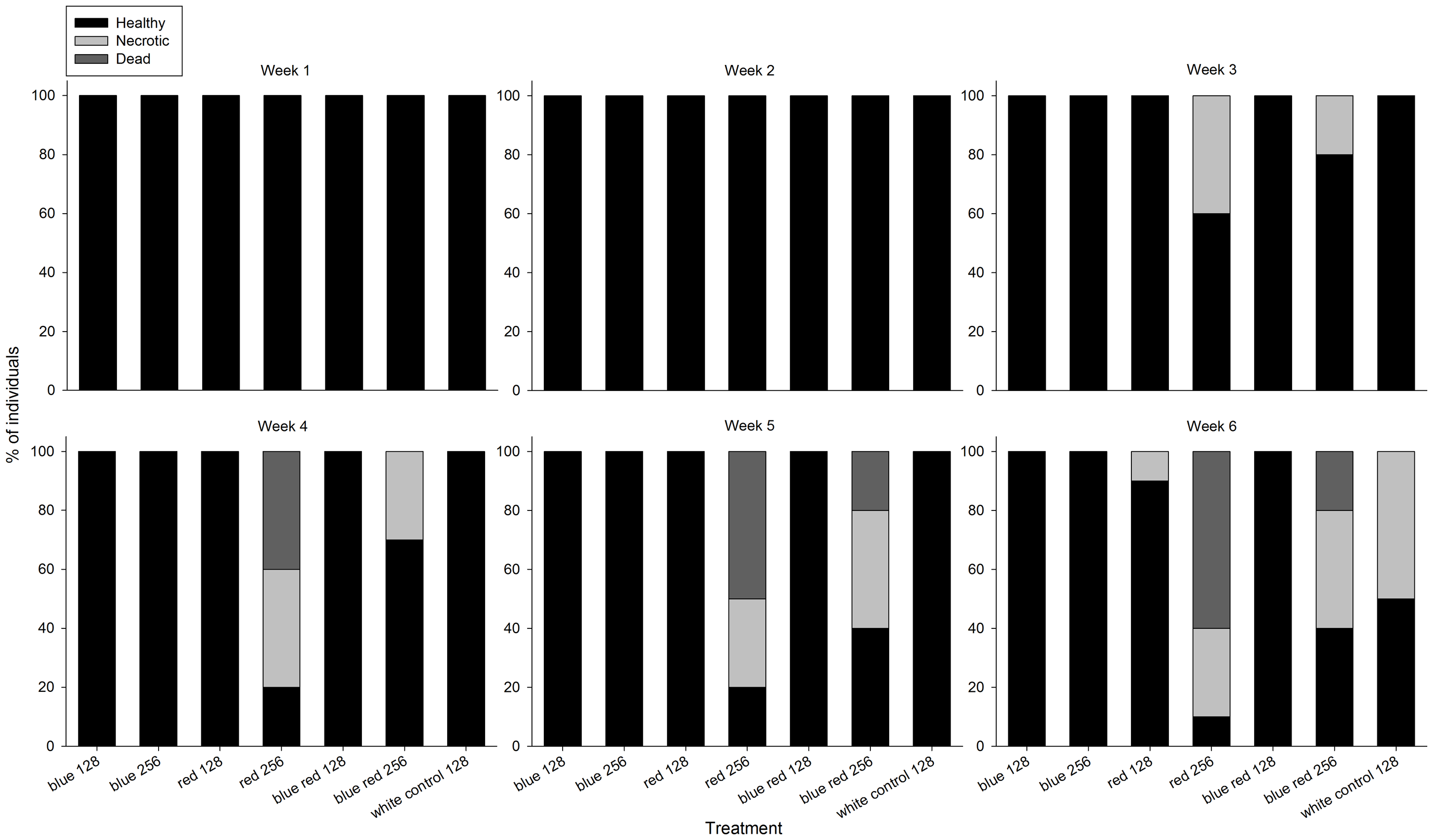
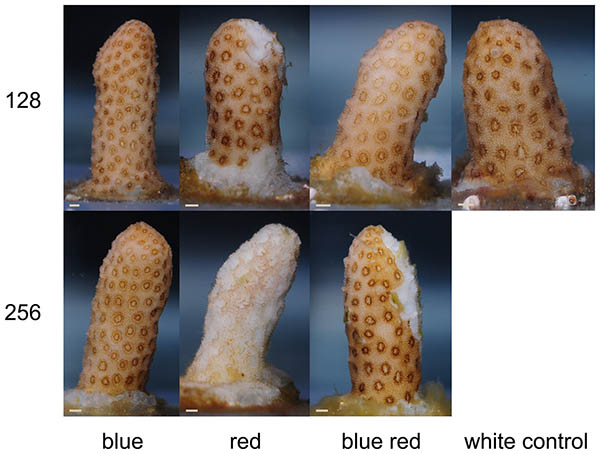
W czasie trwania eksperymentu, korale z różnych grup wykazały wyraźną zmianę kondycji (Foto 2). Po 3 tygodniu korale rosnące pod czerwonym i niebiesko-czerwonym światłem 256 umol m-2 s-1 zaczęły pokazywać nekrozę tkanki, która postępowała w kierunku śmierci korala przez kolejne tygodnie. U korali rosnącymi pod światłem czerwonym i białym 128 umol m-2 s-1 oznaki nekrozy wystąpiły dopiero na koniec eksperymentu. Korale z grup oświetlanych niebieskim światłem nie wykazały oznak nekrozy bez względu na poziom promieniowania.
Foto 2
Gęstość Zooxantelli
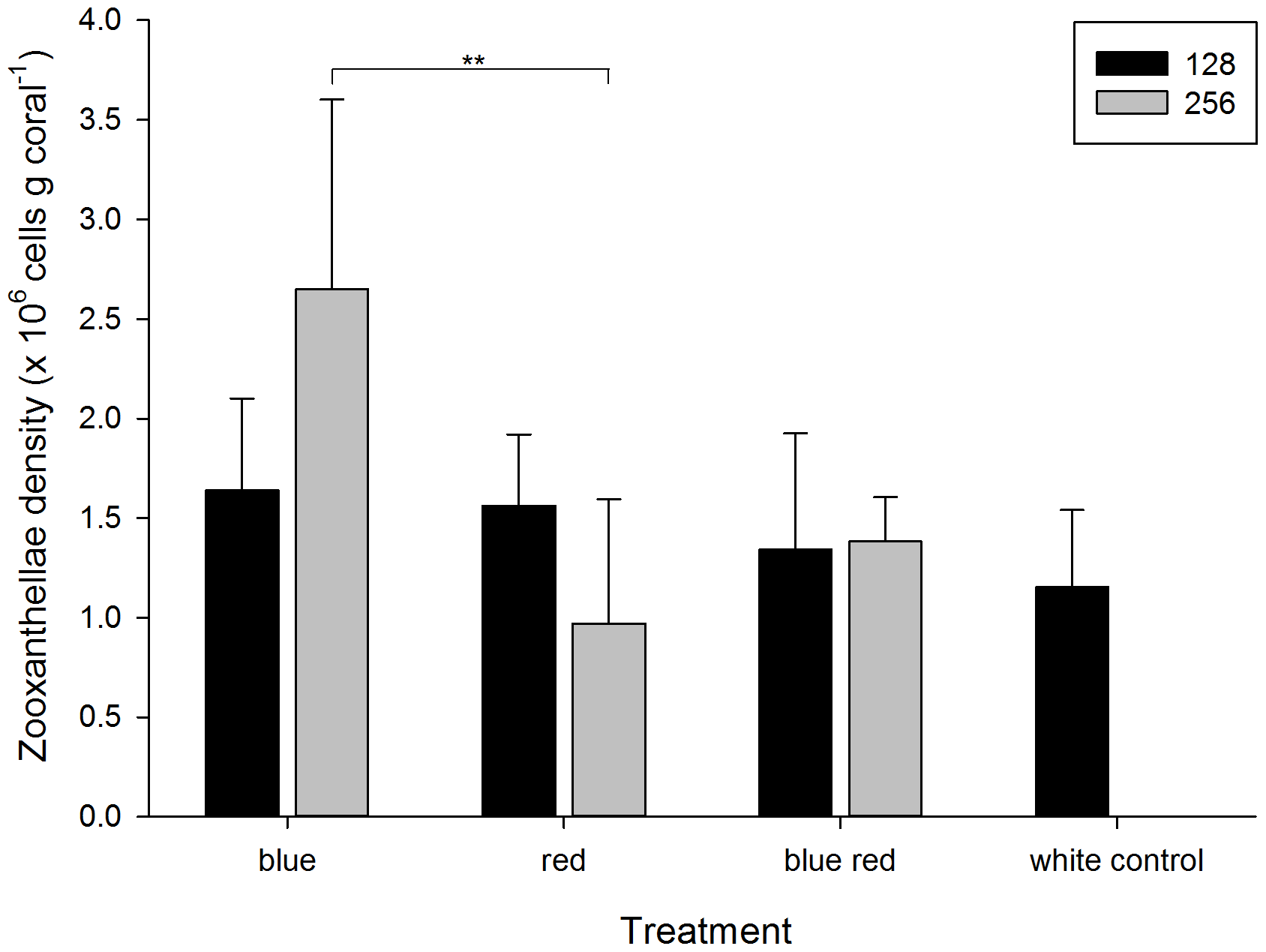
Gęstość zooxantelli na koniec eksperymentu wahała sie od 0,97+/-62×10^6 do 2,65 +/-0,95×10^6 komórek na gram tkanki korala (Foto 3) i była wyraźnie zależna od barwy światła (Tabela 1). Dodatkową zależnością, którą odkryliśmy był związek pomiędzy mocą promieniowania (128 lub 256 umol m-2 s-1) a ilością zooksantelli. Korale rosnące pod niebieskim światłem (256) miały znacząco więcej zooksantelli, niż te które rosły pd światłem czerwonym nawet przy tym samym poziomie mocy. Widoczny był również wzrost ilości zooksantelli u korali spod lampy niebieskiej (256) względem korali spod lampy niebieskiej (128). W przypadku lampy czerwonej zaobserwowano zjawisko odwrotne. Im słabsze światło czerwone tym więcej zooksantelli w tkance korala.
Foto 3
Współczynnik odbicia
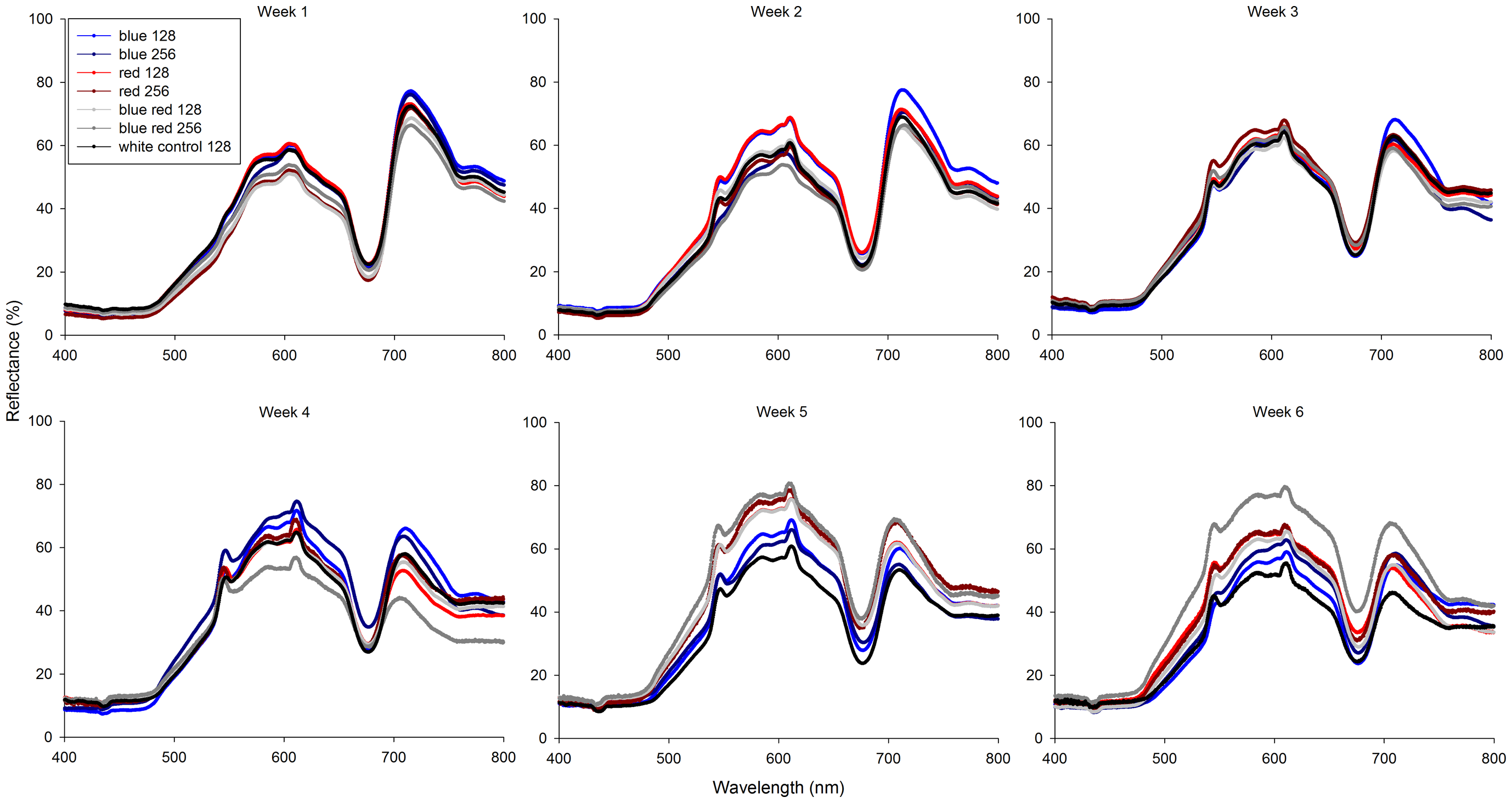
Współczynnik odbicia korali zmieniał się istotnie w ciągu trwania eksperymentu (Foto 6). Od trzeciego tygodnia wszystkie korale zaczęły wykazywać niewielkie i zróżnicowane zwiększenie współczynnika odbicia przy 545 i 611nm. Te piki uzyskały swoje maksima po drugim tygodniu dla światła czerwonego (128) i w czwartym i piątym tygodniu dla światła czerwonego (256). Dodatkowo, wszystkie korale wykazały minima współczynnika odbicia przy długościach poniżej 500nm i przy 670nm. Korale spod światła niebiesko-czerwonego (256) odbiły więcej światła w zakresie 480-750nm z wyraźna zmianą ubarwienia w kierunku żółtopomarańczowego. Na koniec, współczynnik odbicia światła pomiędzy minimum przy 670 nm, maksimum przy 750 nm z czasem maleje dla każdego rodzaju światła.
Wybarwienie
Na koniec eksperymenty wszystkie szczepki zostały ponownie sfotografowane. Egzemplarze rosnące pod światłem białym 128, czerwonym 128 i czerwono niebieskim 128 wykazały wzrost pigmentacji w polipach (foto 7). Dodatkowo korale rosnące pod światłem czerwononiebieskim 256 wykazały wzrost żółtopomarańczowej barwy w koenenchymie (tkance pomiędzy polipami). Pomimo obumierania części korala, pozostała tkanka wyglądała na zdrową, bez śladów bielenia.
Foto 7
Dyskusja
Przeprowadzony eksperyment wykazał odmienny wpływ barwy światła i jego mocy na kondycje i przeżycie korali, gęstość zooxantelli i wybarwienia S. pistillata. Najogólniej można stwierdzić, że światło czerwone wpłynęło negatywnie na ilość zooxantelli. Zdrowie i przeżywalność korali były znacząco zależne od koloru światła. Największy stopień przeżycia miały te korale, które były oświetlone światłem niebieskim (bez względu na jego moc 126 , 256). Jedyne przypadki uszkodzenia tkanki i/lub śmierci korala to te, kiedy korale były oświetlane światłem czerwonym (128, 256) lub niebiesko-czerwonym (256). Jednak w przypadku koloru niebiesko-czerwonego (128) nie zaobserwowano niekorzystnego wpływu czerwonego światła (64) Co może sugerować, że minimalna niekorzystna moc światła czerwonego to około 128 umol m-2 s-1.Pomimo, że korale rosnące w płytkich wodach są poddawane działaniu światła czerwonego o podobnej intensywności co w naszym eksperymencie [8], jest możliwe, że genotyp użyty w naszym przypadku był oryginalnie pobrany z głębokości, gdzie występuje brak światła czerwonego (<10m) [8]. powodując, że stały się one wrażliwe na światło czerwone. Trzeba jednak zauważyć, że na próbkach kontrolnych rosnących pod światłem białym T5 w szóstym tygodniu zaczęły występować początki nekrozy tkanki. Jako, że ten typ i kolor światła jest powszechnie używany do hodowli S. pistillata [4, 17], może to sugerować, że również inne czynniki miały wpływ na nekrozę i śmierć szczepek pod koniec eksperymentu. Potencjalnym kandydatem jest stężenie cynku, który jako składnik wielu enzymów pełniących istotną rolę w metabolizmie i wydajności fotosyntezy w symbiontach S. pitillata [23]. Mówiąc dokładniej, stężenie cynku w wodzie, podczas eksperymentu sięgało 79,7ug/L, co jest stężeniem toksycznym dla niektórych gatunków korali [24]. Można więc wyciągnąć wniosek, że wąskie spektrum niebieskiego światła jest preferowane w środowiskach bogatych w cynk. Jednak nie znane są konkretne zależności. Możliwe że niebieskie światło chroni przed wpływem cynku [25, 26, 27] przez zwiększoną produkcję ochronnych protein [7]. Spektrum światła wpłynęło również na gęstość zooxantelli, która była zdecydowanie większa pod światłem niebieskim (256) niż czerwonym (256). Wyraźnie dało się zauważyć że zwiększona moc niebieskiego światła wpłynęła również na ilość symbiontów. Jest to sprzeczne z innymi raportami, które wskazują na wzrost ilości zooxantelli przy niższych poziomach naświetlenia [22, 29, 30], co jest obserwowane w naturze gdzie wraz ze wzrostem głębokości, zwiększa się proporcjonalna ilość światła niebieskiego. Pomimo tego, że wzrost ilości zooxantelli jest zwykle związany ze zmniejszonym naświetlaniem, nasze rezultaty sugerują,że zwiększony stosunek światła niebieskiego do czerwonego, może być ważną metodą regulacji ilości zooksantelli w tkance korala. Jako, że to doświadczenie wykazuje odwrotny trend, możliwe, że właśnie te barwy odgrywają znaczącą rolę w kontroli ilości zooksantelli, gdzie kolor niebieski stymuluje wzrost symbiontów, a kolor czerwony go hamuje. Ta teoria, jest w zgodzie z wynikami testu z lampą niebiesko-czerwoną (Foto 3), gdzie można założyć, że obecność barwy niebieskiej i czerwonej się wzajemnie kompensują. Te wyniki jednak stoją w sprzeczności z badaniami Kenziego [5], który wykazał, że światło białe i niebieskie mają podobny wpływ na ilość i zagęszczenie zooksantelli w tkance korala. Wszystkie korale użyte w tym eksperymencie od drugiego tygodnia wykazywały zmianę współczynnika odbicia z pikami w 545 i 611nm. Możliwe, że jest to spowodowane wzrostem produkcji zielonych i czerwonych protein fluorescencyjnych [7, 32, 33, 34] co mogłoby być mechanizmem ochronnym na podwyższone stężenie cynku [12, 25, 26, 27, 28]. Oba minima obserwowane przy długościach fal 440nm i 670nm są prawdopodobnie spowodowane obecnością chlorofilu a, który ma zwiększoną absorpcje światła właśnie przy tych długościach. Pod koniec eksperymentu korale rosnące pod niebiesko-czerwoną lampa (256) wykazały zmiany ubarwienia w kierunku koloru żółtopomarańczowego. Jest to zgodne z wzorcem zmiany współczynnika odbicia w okolicach od zielonej do czerwonej cześć spektrum (540-650nm). Nie jest jasne dlaczego nastąpiła zmiana ubarwienia, aczkolwiek może być to spowodowane zwiększoną pojemnością dla fluorescencji UV. Pomimo, że w handlu jasne i fluaryzujące ubarwienie korali jest bardzo ważne ze względu na ich cenę [17], nasze testy wykazały tylko niewielką zmianę w wybarwieniu S. pistillata. To oznacza, że w przypadku tego gatunku, łatwo uzyskać optymalny stosunek pomiędzy wzrostem a zużytą energią bez konieczności rezygnacji z ubarwienia. wnioski wyraźnie sugerują, zę czerwone światło aktywnie wpływ na zmniejszenie gęstości zooxantelli w tkance S. pitillata. A ekologiczne konsekwencje tego są takie, że czerwone światło może być sygnałem wysokiego promieniowania, a dzięki zwiększeniu produkcji chlorofilu a, uruchomione zostają mechanizmy ochrony przed niekorzystnym promieniowaniem [8, 15, 16]. Mechanizmy te są prawdopodobnie połączone z obecnością wrażliwych na kolor czerwony, barwników fotochromowych, które u roślin odpowiadają za syntezę chlorofili [38, 39] , a które również zostały wykryte w zooxantellach. Niebieskie światło natomiast pozytywnie wpływa na zdrowie, przeżywalność, gęstość symbiontów u S. pistillata.Ta ważna rola niebieskiego światła, wpływającego pozytywnie na kondycje S. pistillata jest prawdopodobnie związana z obecnością wrażliwych na światło niebieskie krypto-chromów, które biorą aktywny udział w regulacji rytmu dobowego i rozmnażania płciowego korali [3, 40, 41, 42] i zooxantelli. Ostatecznie, nasze odkrycia, przez późniejsze dopasowanie wąskiego widma niebieskiego do konkretnego gatunku korala, mogą przynieść korzyści w zrównoważonej hodowli tego gatunku.
Bibliografia:
1.Muscatine L, McCloskey LR, Marian RE (1981) Estimating the daily contribution of carbon from zooxanthellae to coral animal respiration. Limnol Oceanogr 26: 601–611.
2. Davies PS (1984) The role of zooxanthellae in the nutritional energy requirements of Pocillopora eydouxi. Coral Reefs 2: 181– 186.
3. Levy O, Appelbaum L, Leggat W, Gothlif Y, Hayward DC, et al. (2007) Light-responsive cryptochromes from a simple multicellular animal, the coral Acropora millepora. Science 318: 467–70.
4. Osinga R, Schutter M, Griffioen B, Wijffels RH, Verreth JAJ, et al. (2011) The biology and economics of coral growth. Mar Biotechnol 13: 658–671.
5. Kinzie III RA, Jokiel PL, York R (1984) Effects of light of altered spectral composition on coral zooxanthellae associations and on zooxanthellae in vitro. Mar Biol 78: 239–248.
6. Kinzie III RA, Hunter T (1987) Effect of light quality on photosynthesis of the reef coral Montipora verrucosa. Mar Biol 94 : 95–109.
7. D’Angelo C, Denzel A, Vogt A, Matz MV, Oswald F, et al. (2008) Blue light regulation of host pigment in reef-building corals. Mar Ecol Prog Ser 364: 97–106.
8. Mass T, Kline DI, Roopin M, Veal CJ, Cohen S, et al. (2010) The spectral quality of light is a key driver of photosynthesis and photoadaptation in Stylophora pistillata colonies from different depths in the Red Sea. J Exp Biol 213: 4084–4091.
9. Iglesias-Prieto R, Trench RK (1997) Acclimation and adaptation to irradiance in symbiotic dinoflagellates. II. Response of chlorophyll-protein complexes to different photon-flux densities. Mar Biol 130: 23–33.
10. Iglesias-Prieto R, Beltrán VH, LaJeunesse TC, Reyes-Bonilla H, Thomé PE (2004) Different algal symbionts explain the vertical distribution of dominant reef corals in the eastern Pacific. Proc R Soc Lond B 271: 1757–1763.
11. Wang L-H, Liu Y-H, Ju Y-M, Hsiao Y-Y, Fang L-S, et al. (2008) Cell cycle propagation is driven by light–dark stimulation in a cultured symbiotic dinoflagellate isolated from corals. Coral Reefs 27: 823–835.
12. Bou-Abdallah F, Chasteen ND, Lesser MP (2006) Quenching of superoxide radicals by green fluorescent protein. Biochim Biophys Acta 1760: 1690–1695.
13. Gilmore AM, Larkum AWD, Salih A, Itoh S, Shibata Y, et al. (2003) Simultaneous time resolution of the emission spectra of fluorescent proteins and zooxanthellar chlorophyll in reef-building corals. Photochem Photobiol 77: 515–523.
14. Salih A, Larkum A, Cox G, Kuhl M, Hoegh-Guldberg O (2000) Fluorescent pigments in corals are photoprotective. Nature 408: 850–853.
15. Huang X-D, Dixon DG, Greenberg BM (1995) Increased polycyclic aromatic hydrocarbon toxicity following their photomodification in natural sunlight: Impacts on the duckweed Lemna gibba L. G3. Ecotoxicol Environ Saf 32: 194–200.
16. Demmig-Adams B, Adams WW (1996) Xanthophyll cycle and light stress in nature: uniform response to excess direct sunlight among higher plant species. Planta 198: 460–470.
17. Rocha RJM, Pimentel T, Serôdio J, Rosa R, Calado R (2013) Comparative performance of light emitting plasma (LEP) and light emitting diode (LED) in ex situ aquaculture of scleractinian corals. Aquaculture 402–403: 38–45.
18. Leal MC, Calado R, Sheridan C, Alimonti A, Osinga R (2013) Coral aquaculture to support drug discovery. Trends Biotechnol 31: 555–561.
19. Sheridan C, Kramarsky-Winter E, Sweet M, Kushmaro A, Leal MC (2013) Diseases in coral aquaculture: causes, implications and preventions. Aquaculture 396–399: 124–135.
20. Schreiber U, Schliwa U, Bilger W (1986) Continuous recording of photochemical and nonphotochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer. Photosynth Res 10: 51–62.
21. Rouse J, Haas R, Schell J, Deering D (1973) Monitoring vegetation systems in the Great Plains with ERTS. ERTS-1 Symp, 3rdWashington, DC: NASA SP-351, Greenbelt, MD, pp 309–317.
22. Rocha RJM, Calado R, Cartaxana P, Furtado J, Serôdio J (2013) Photobiology and growth of leather coral Sarcophyton sf. glaucum fragments under low light in a recirculated system. Aquaculture 414–415: 235–242.
23. Ferrier-Pagès C, Houlbrèque F, Wyse E, Richard C, Allemand D, et al. (2005) Bioaccumulation of zinc in the scleractinian coral Stylophora pistillata. Coral Reefs 24: 636–645.
24. Reichelt-Brushett AJ, Harrison PL (2005) The effect of selected trace metals on the fertilization success of several scleractinian coral species. Coral Reefs 24: 524–534.
25. Alia, Prasad KVSK, Paradha Saradhi P (1995) Effect of zinc on free radicals and proline in Brassica and Cajanus. Phytochem39: 45–47.
26. Daniels WMU, Hendricks J, Salie R, van Rensburg SJ (2004) A mechanism for zinc toxicity in neuroblastoma cells. Metabol Brain Dis 19: 79–88.
27. Prasad KVSK, Paradha Saradhi P, Sharmila P (1999) Concerted action of antioxidant enzymes and curtailed growth under zinc toxicity in Brassica juncea. Environ Exp Bot 42: 1–10.
28. Palmer CV, Modi CK, Mydlarz LD (2009) Coral fluorescent proteins as antioxidants. PLoS ONE 4: e7298.
29. Rocha RJM, Serôdio J, Leal MC, Cartaxana P, Calado R (2013) Effect of light intensity on post-fragmentation photobiological performance of the soft coral Sinularia flexibilis. Aquaculture 388–391: 24–29.
30. Titlyanov EA, Titlyanova TV (2002) Reef-building corals – symbiotic autotrophic organisms: 2. Pathways and mechanisms of adaptation to light. Russ J Mar Biol 28: S19–S31.
31. Jones RJ, Hoegh-Guldberg O (2001) Diurnal changes in the photochemical efficiency of symbiotic dinoflagellates (Dinophyceae) of corals: photoprotection, photoinactivation and the relationship to coral bleaching. Plant Cell Environ 24: 89–99.
32. Dove SG, Hoegh-Guldberg O, Ranganathan S (2001) Major colour patterns of reef-building corals are due to a family of GFP-like proteins. Coral Reefs 19: 197–204.
33. Wilmann PG, Petersen J, Pettikiriarachchi A, Buckle AM, Smith SC, et al. (2005) The 2.1 Å Crystal structure of the far-red fluorescent protein HcRed: Inherent conformational flexibility of the chromophore. J Mol Biol 349: 223–237.
34. Matz MV, Marshall NJ, Vorobyev M (2006) Symposium-in-Print: Green fluorescent protein and homologs – Are corals colorful? Photochem Photobiol 82: 345–350.
35. Jeffrey SW, Haxo FT (1968) Photosynthetic pigments of symbiotic dinoflagellates (zooxanthellae) from corals and clams. Biol Bull 135: 149–165.
36. Halldal P (1968) Photosynthetic capacities and photosynthetic action spectra of endozoic algae of the massive coral Favia. Biol Bull 134: , 411–424.
37. Reef R, Kaniewska P, Hoegh-Guldberg O (2009) Coral skeletons defend against ultraviolet radiation. PLoS ONE 4: e799
38. Huq E, Al-Sady B, Hudson M, Kim C, Apel K, et al. (2004) PHYTOCHROME-INTERACTING FACTOR 1 is a critical bHLH regulator of chlorophyll biosynthesis. Science 305: 1937–1941.
39. Liu X, Chen C-Y, Wang K-C, Luo M, Tai R, et al. (2013) PHYTOCHROME INTERACTING FACTOR3 associates with the histone deacetylase HDA15 in repression of chlorophyll biosynthesis and photosynthesis in etiolated Arabidopsis seedlings. The Plant Cell 25: 1258–1273.
40. Sorek M, Levy O (2012) Influence of the quantity and quality of light on photosynthetic periodicity in coral endosymbiotic algae. PLoS ONE 7: e43264.
41. Hoadley KD, Szmant AM, Pyott SJ (2011) Circadian clock gene expression in the coral Favia fragum over diel and lunar reproductive cycles. PLoS One 6: e19755.
42. Shoguchi E, Tanaka M, Shinzato C, Kawashima T, Satoh N (2013) A genome-wide survey of photoreceptor and circadian genes in the coral, Acropora digitifera. Gene 515: 426–431.
43. Brunelle SA, Hazard ES, Sotka EE, van Dolah FM (2007) Characterization of a dinoflagellate cryptochrome blue-light receptor with a possible role in circadian control of the cell cycle. J Phycol 43: 509–518.
Artykuł publikowany na Reefhub.pl na licencji Creative Commons